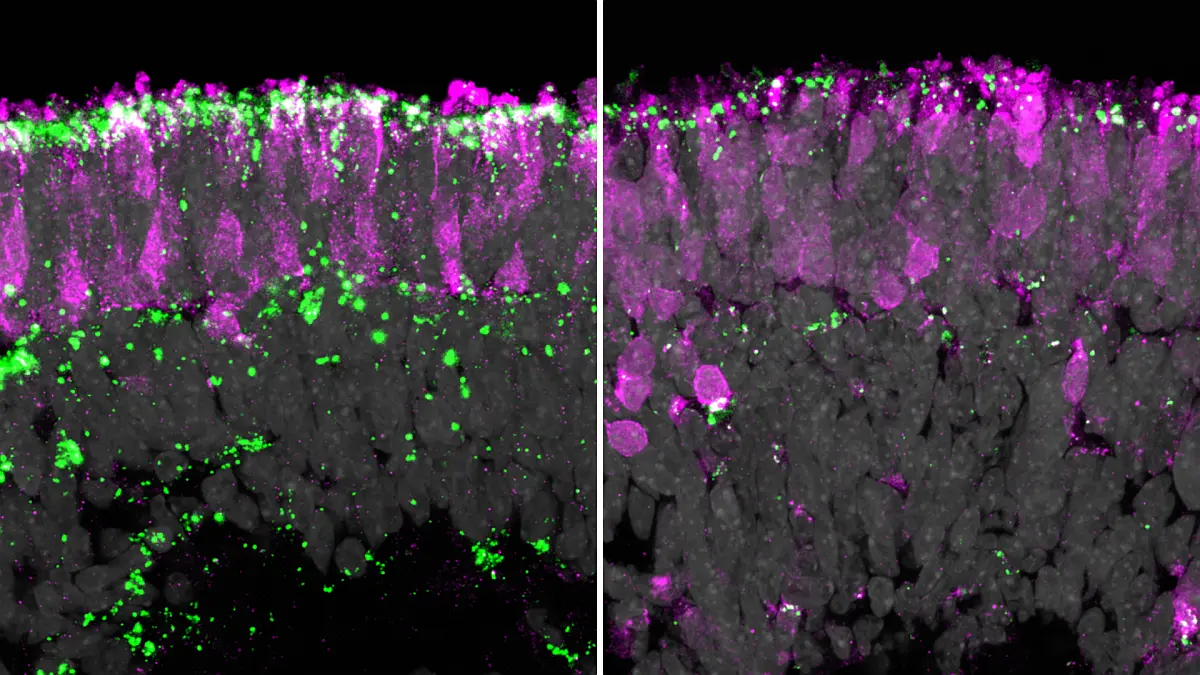
Mit künstlicher Intelligenz das Sehsystem im Gehirn verstehen: Ein internationales Forschungsteam (MICrONS) hat neue KI-Modelle entwickelt, um die komplexe Verarbeitung von visuellen Reizen im Gehirn zu entschlüsseln. Die Forschenden untersuchten, wie Form, Verschaltungsmuster und Aktivität von Nervenzellen im Mäusegehirn zusammenhängen.
Die Studie „Foundation Model of Neural Activity Predicts Response to New Stimulus Types and Anatomy“ [1] stellt ein neues KI-Modell vor, das aus großen Datenmengen gelernt hat und sich flexibel auf neue Aufgaben übertragen lässt. Das Team analysierte dazu über 135.000 Nervenzellen im Sehsystem von Mäusen und entwickelte ein Modell, das zuverlässig neuronale Reaktionen auf neue Reize voraussagt – sogar auf solche, die es während des Trainings nie gesehen hat. „Unser Modell kann beispielsweise Antworten auf kohärente Bewegungsmuster, Rauschbilder und statische natürliche Bilder vorhersagen, ohne jemals mit diesen Reizarten konfrontiert worden zu sein“, erklärt Prof. Dr. Fabian Sinz vom Institut für Informatik und dem Campus-Institut Data Science der Universität Göttingen, der das Modell mitentwickelt hat. Diese Arten von Reizen sind entscheidend für das Verständnis neuronaler Informationsverarbeitung.
Fließende Übergänge zwischen Zelltypen
In einer weiteren Studie untersuchte das Team die Form und Struktur von bestimmten Nervenzellen im Sehbereich des Gehirns, dem sogenannten visuellen Kortex. „An unsupervised map of excitatory neurons’ dendritic morphology in the mouse visual cortex“ [2] zeigt, dass die sogenannten Pyramidenzellen – Zellen mit pyramidenartiger Form, die wichtige Signale an andere Zellen im visuellen Kortex weitergeben – vielfältiger sind als bisher angenommen. Der Leiter der Studie, Prof. Dr. Alexander Ecker vom selben Institut, erklärt: „Wir haben Verfahren des maschinellen Lernens entwickelt, welche die komplexe 3D-Form einer Nervenzelle in einer Art Strichcode kodieren. Diese Strichcodes können dann visualisiert und analysiert werden.“ Anhand von 30.000 Pyramidenzellen fanden die Forschenden heraus, dass diese fließende Übergänge zwischen Zelltypen aufweisen, anstatt klar abgegrenzter Typen.
Das MICrONS-Projekt
Am MICrONS-Projekt [3], in dessen Rahmen die beiden Studien entstanden, waren zahlreiche Forschungseinrichtungen beteiligt – darunter das Baylor College of Medicine, das Allen Institute for Brain Science und die Princeton University. Im Rahmen dieses Projekts erstellte das Team den „MICrONS Multi-Area Datensatz“. Er umfasst sowohl die Struktur und die Vernetzung von Nervenzellen, als auch ihre Antworteigenschaften auf verschiedene visuelle Reize. Derzeit ist es der größte Datensatz dieser Art, der jemals in einem Säugetiergehirn erhoben wurde. Die Daten wurden in der Hauptstudie „Functional Connectomics Spanning Multiple Areas of Mouse Visual Cortex“ beschrieben.
Digitaler Zwilling
Die von den Göttinger Forschenden mitentwickelten Modelle wurden unter anderem dazu genutzt, einen „digitalen Zwilling“ der Nervenzellen des MICrONS-Datensatzes zu erstellen. Dieser digitale Zwilling konnte Form und Struktur von Pyramidenzellen erfolgreich vorhersagen, ohne dass anatomische Informationen für das Training verwendet wurden. Das deutet darauf hin, dass funktionelle und anatomische Eigenschaften von Nervenzellen eng miteinander verknüpft sind.
Die Zukunft: Experimente in-silico
Die Forschungsergebnisse liefern wichtige Einblicke in die Organisation des Gehirns und könnten künftig dazu beitragen, effizientere neurowissenschaftliche Experimente zu ermöglichen. Statt aufwändige und zeitintensive Experimente in-vivo – also im lebenden Tier – durchzuführen, könnten Forschende zunächst Experimente in-silico – also im Modell – durchführen, um vielversprechende Hypothesen zu identifizieren und diese erst anschließend in Experimenten zu verifizieren.
Referenzen:
- Eric Y. Wang et al. Foundation model of neural activity predicts response to new stimulus types. Nature (2025). DOI: https://doi.org/10.1038/s41586-025-08829-y
- Marissa A. Weis et al. An unsupervised map of excitatory neurons’ dendritic morphology in the mouse visual cortex. Nature Communications (2025). DOI: https://doi.org/10.1038/s41467-025-58763-w
- The MICrONS Project: https://www.nature.com/immersive/d42859-025-00001-w/index.html
Quelle: Pressemitteilung der Georg-August-Universität Göttingen vom 10.04.2025
Bildquelle:© The MICrONS Project