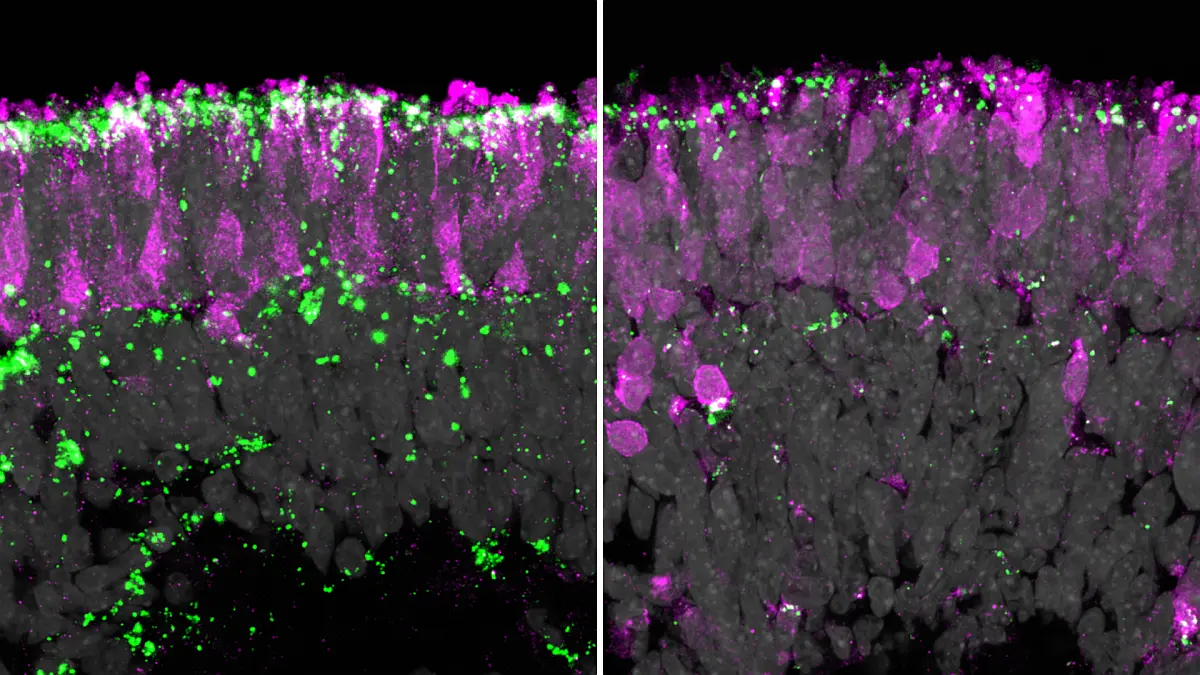
Die U.S. Food and Drug Administration (FDA) hat die Zulassung für einen IND-Antrag (Investigational New Drug) einer klinischen Studie mit EA 2351 erteilt. Dieser innovative Wirkstoff gibt Patientinnen und Patienten mit geografischer Atrophie, einer fortgeschrittenen Form der altersbedingten Makuladegeneration (AMD), Hoffnung. Die mit Spannung erwartete First-in-Human-Studie soll 2024 beginnen.
Dieser Meilenstein ist das zweite Programm des Unternehmens Endogena Therapeutics Inc., das in klinische Studien übergeht und auf der Dynamik des laufenden EA 2353-Programms für Retinitis pigmentosa aufbaut, das im Juli 2022 gestartet wurde. EA-2351 und EA-2353 stellen unterschiedliche Ansätze dar, die jeweils über unterschiedliche Wege auf bestimmte Zellpopulationen abzielen und auf ihren einzigartigen chemischen Strukturen basieren. Während sich EA-2353 auf die Aktivierung einer Gruppe von Zellen im Zusammenhang mit Retinitis pigmentosa konzentriert, fokussiert sich EA-2351 auf retinale Pigmentepithelzellen (RPE). Diese RPE-Zellen spielen eine zentrale Rolle bei der Regeneration und Wiederherstellung der Photorezeptorfunktion.
Entwicklung regenerativer Medikamente
Matthias Steger, PhD, MBA, CEO, ist begeistert: „Wir freuen uns darauf, eine weitere potenzielle Therapie für eine Erkrankung mit hohem ungedecktem medizinischem Bedarf weiterzuentwickeln und damit Hoffnung für Patienten zu geben, die von AMD betroffen sind.“
Endogena Therapeutics Inc. ist ein Biotech-Unternehmen im klinischen Stadium, das endogene regenerative Medikamente zur Reparatur und Regeneration von Geweben und Organen entdeckt und entwickelt. Das Konzept basiert auf der selektiven Regulation endogener adulter Stamm- und Vorläuferzellen zur kontrollierten Gewebereparatur durch kleine Moleküle. Die Programme zielen auf degenerative Erkrankungen des Auges ab, einschließlich Retinitis pigmentosa und geografischer Atrophie. Endogena ist in San Francisco, USA, registriert und hat seinen Hauptsitz in Zürich, Schweiz, und eine Forschungseinrichtung bei JLABS in Toronto, Kanada.
Quelle: Pressemitteilung der Endogena Therapeutics Inc. vom 24.10.2023
Bildquelle: © DigitalGenetics – stock.adobe.com