Quelle und Bildquelle: © Aus Uroforum, Heft 05/2023
Jennifer Kranz, Matthias Saar
Die Behandlung des kastrationsresistenten Prostatakarzinoms hat sich durch die Zulassung innovativer Therapien fortwährend verbessert. Aktuelle Studiendaten zeigen ein medianes Gesamtüberleben der Patienten von mehr als 3 Jahren [1]. Im Folgenden soll ein Überblick über die derzeit in Deutschland verfügbaren und in Aussicht stehenden Therapieoptionen gegeben werden.
Das kastrationsresistente Prostatakarzinom
Ein kastrationsresistentes Prostatakarzinom liegt vor, wenn Patienten medikamentös (GnRH-Agonisten, GnRH-Antagonisten) oder chirurgisch kastriert wurden und ein PSA-Anstieg in drei aufeinander folgenden Analysen in mindestens einwöchigem Abstand auftritt. Hierbei liegt definitionsgemäß ein PSA-Wert > 2 ng/ml vor oder es besteht ein radiologischer Progress (nach Definition der Prostate Cancer Working Group), während das Serumtestosteron 50 ng/dl nicht überschreitet.
Nicht metastasiert
Sofern Patienten ohne Anhalt für eine Fernmetastasierung kastrationsresistent werden, spricht man von einem nicht metastasierten kastrationsresistenten Prostatakarzinom. Diese Patienten müssen von metastasierten Patienten abgegrenzt betrachtet werden und zeigen ein deutlich verbessertes Überleben von ≥ 6 Jahren [2]. Diese Patienten müssen vor Therapieeinleitung jedoch in einer Schnittbildgebung des Abdomens und Beckens sowie in einer Knochenszintigraphie metastasenfrei sein und eine PSA-Verdopplungszeit von ≤ 10 Monaten aufweisen. Bisher wurden die sekundären Hormontherapien Apalutamid, Darolutamid und Enzalutamid zugelassen [2, 3, 4]. Lediglich Lymphknotenmetastasen bis zu 2 cm, die unterhalb der Aortenbifurkation zur Darstellung kommen, waren unter der Gabe von Apalutamid und Darolutamid erlaubt. Erfreulicherweise zeichnen sich diese Therapien durch eine sehr hohe Effektivität mit PSA-Ansprechraten von > 50 % in knapp 90 % der Patienten und einer Verzögerung tumorbedingter Symptome bei gleichbleibender Lebensqualität aus [2, 4]. Offensichtlich sprechen die Patienten im weiteren Krankheitsverlauf auch auf die weiteren zugelassenen Therapien an, ohne dass hier eine Präferenz für eine bestimmte Substanz bei Auftreten von Metastasen gesehen werden kann [5].
Metastasiert
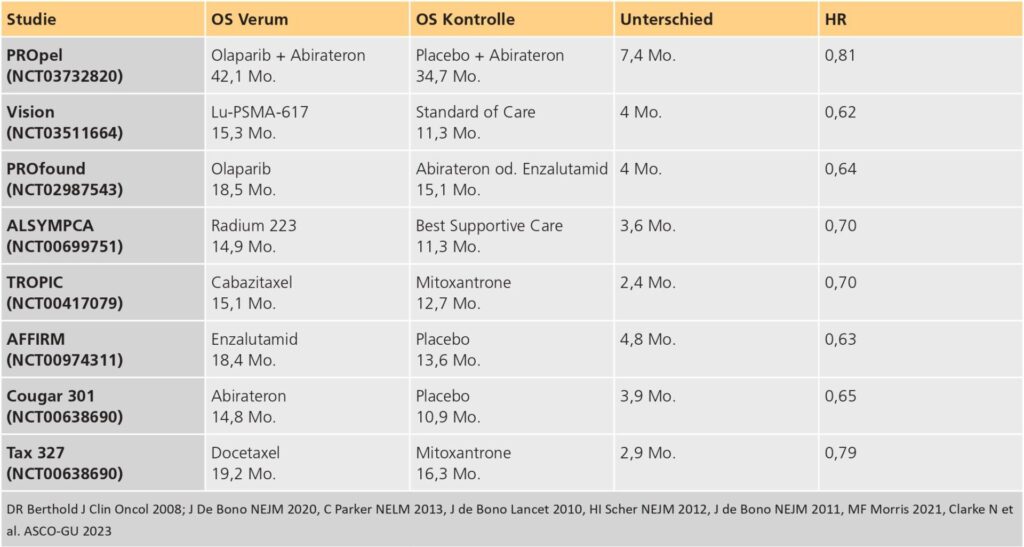
Deutlich vielfältiger und in ihrem Anwendungsspektrum komplexer sind die Therapien beim metastasierten kastrationsresistenten Prostatakarzinom (mCRPC). Dabei waren Chemotherapien initial als Standardtherapie für solche Patienten anzusehen; Docetaxel wurde nach positiver Testung in der TAX 327-Studie (Overall Survival (OS) 19,2 Mo vs. 16,3 Mo) 2004 zugelassen [6]. Es folgte mit Cabazitaxel eine weitere zytostatische Therapie, die speziell auf Patienten, die eine Resistenz auf Docetaxel erfahren hatten, zugeschnitten war und in 2010 zugelassen wurde [7]. Ein großer Meilenstein wurde dann ein Jahr später erreicht, als in der Cougar 301-Studie gezeigt werden konnte, dass auch in der Kastrationsresistenz eine Inhibition des CYP17-Enzyms mit konsekutiver Blockade der extragonadalen, testikulären und intratumoralen Androgenbiosynthese effektiv ist und deutlich geringere Nebenwirkungen als eine Chemotherapie aufweist [8]. Es folgte auch die Zulassung von Enzalutamid, einem Androgenrezeptorblocker, der kompetitiv an die Ligandenbindungsdomäne des Androgenrezeptors andockt und hierdurch dessen Translokation in den Zellnukleus verhindert, was Rezeptorkofaktoren und die Transkription inhibiert [9]. Während diese primär nur nach Docetaxel-Chemotherapie zugelassenen Androgen-Rezeptor-gerichteten-Substanzen (ARPi) auch als Erstlinientherapie, also vor Docetaxel, getestet und zugelassen wurden [10, 11], konnte für Patienten mit symptomatischen Knochenmetastasen eine weitere Therapie, nämlich Radium-223, als effektiver a-Strahler zugelassen werden [12]. Aktuell wird der Therapiealgorithmus beim mCRPC durch zwei weitere, durch spezifische Patientenkriterien in ihrer Wirksamkeit abschätzbare Therapieoptionen erweitert, die in der Folge etwas genauer beleuchtet werden.
In der Vision-Studie wurden im besten Sinne eines theranostischen Ansatzes – also der Verknüpfung von in diesem Fall Prostata-spezifischen-Membranantigen (PSMA)-gerichteter Diagnostik und Therapie – Patienten eingeschlossen, die PSMA-positive Läsionen zeigten und zuvor mit einer neuartigen Androgendeprivation und einem Taxan therapiert wurden. Im Kontrollarm war eine tumorspezifische Therapie ebenfalls erlaubt, der Therapieplan dieser Patienten durfte jedoch keine Chemo- und Immuntherapie oder Radium-223 enthalten. Im Ergebnis zeigte die Studie einen Vorteil der Gabe von 177Lu-PSMA-617 von 4 Monaten im Gesamtüberleben gegenüber der Standard-of-Care-Therapie (HR 0,62; 95%-KI 0,52–0,74; p > 0,001) [13]. Noch im Dezember 2022 wurde die Zulassung für diese bereits seit einigen Jahren nach Ausschöpfung aller zugelassenen Therapieoptionen an nuklearmedizinischen Zentren eingesetzte Substanz erteilt. Pluvicto® ist in Kombination mit einer Androgendeprivationstherapie (ADT) mit oder ohne Inhibition des Androgenrezeptor-Signalwegs zur Behandlung von erwachsenen Patienten mit einem progredienten PSMA-positiven mCRPC, die zuvor mittels Inhibition des AR-Signalwegs und taxanbasierter Chemotherapie behandelt wurden, indiziert. Hervorzuheben ist eine komplette Remission (CR) von 9,2 % und ein partielles Ansprechen (PR) von 41,8 % der behandelten Patienten im Vergleich zu keinerlei CR sowie lediglich 3,1 % PR in der Kontrollgruppe. Es macht also durchaus Sinn, Patienten mit stark PSMA-aviden Läsionen bereits in der dritten Therapielinie dieser Therapie zuzuführen. Allerdings sollten als Nebenwirkungen v. a. eine ausgeprägtere Fatigue, eine Mundtrockenheit (38,8 %) sowie das Anämierisiko mit den Patienten diskutiert werden. Nichtsdestotrotz sprachen im getesteten Setting die gesundheitsbezogene Lebensqualität und Schmerzlinderung für den PSMA-gerichteten Therapieansatz.
PARP-Inhibitoren
Ein weiterer Therapieansatz ist die Behandlung mittels PARP-Inhibitoren. Sie basiert auf dem Grundsatz, dass durch die medikamentöse Blockade der humanen Poly-ADP-Ribose-Polymerase (PARP) DNA-Einzelstränge nicht mehr repariert werden können und die Tumorzellen dadurch einem programmierten Zelltod zum Opfer fallen. Diese Therapie funktioniert dann am besten, wenn der Tumor bereits einen Defekt in der homologen Rekombinations-Reparatur (HRR) aufweist, also vermehrt Angriffspunkte für den PARP-Inhibitor vorliegen. In der Profound-Studie konnte nach diesem Prinzip bereits 2020 gezeigt werden, dass Patienten mit einer somatischen oder genetischen Mutation im breast cancer gene 1/2 (BRCA) oder ATM (Ataxia telangiectasia mutated) mit einem PARP-Inhibitor behandelt werden sollen (OS 19,1 Mo. vs. 14,7 Mo.; HR 0,69; 95%-KI 0,50–0,97; p = 0,02) [14]. Daher wird auch die Testung kastrationsresistenter Patienten auf eine BRCA 1/2-Mutation empfohlen und es soll eine Therapie mit Olaparib bei Mutationsnachweis angeboten werden [15].
Nachdem die Profound-Studie nur die Überlegenheit gegenüber Patienten, die mit einem ARPi behandelt wurden, nachwies, zeigen aktuelle Daten aus der TRITON-3-Studie, welche einen weiteren PARP-Inhibitor (Rucaparib) testete, dass bei BRCA-positiven Patienten die mutationsspezifische Therapie auch gegenüber der Chemotherapie besser abschneidet [16]. Die Therapie mittels PARP-Inhibitoren ist also sehr effektiv, jedoch nur limitiert einsetzbar, da in klinischen Kollektiven nur bei ca. 11 % der Patienten ein Mutationsnachweis an Tumorgewebe gelingt [17, 18]. Daher verfolgten Kombinationstherapien eines PARP-Inhibitors mit einem ARPi eine weitere, sehr raffinierte Strategie. Zum einen kontrolliert PARP die Funktion des Androgenrezeptors und ist in die AR-abhängige Transkription involviert [19]. Zum anderen reguliert die AR-Aktivität auch DNA-Reparaturmechanismen, womit eine Blockade des AR auch eine Defizienz des Reparaturmechanismus induziert [20]. Die erste Phase-III-Studie, die untersuchte, ob durch diese Synergie eine sogenannte „BRCA-ness“ induziert werden kann, war die PROpel-Studie, in der als Erstlinientherapie bei Patienten mit mCRPC Olaparib in einer Dosis von 300 mg in Kombination mit 1.000 mg Abirateron gegen die alleinige Abiraterongabe getestet wurde. Nachdem sich bereits im radiographisch progressionsfreien Überleben eine Verbesserung zugunsten des Verum-Arms gezeigt hatte wurde die Kombinationstherapie im Dezember 2022 für die Behandlung von Patienten mit mCRPC, bei denen eine Chemotherapie nicht indiziert ist, zugelassen. Die später publizierten OS-Ergebnisse zeigen einen Vorteil von 7,4 Monaten für die Kombinationstherapie (HR 0,81; 95%-KI 0,67–1,00; p = 0,0544) [1]. Die Zulassung ist relativ weit gefasst, was aber positiv verstanden werden kann, denn es bleibt in der Anwendung Spielraum für diese Kombinationstherapie und damit eine weitere Therapieoption für selektierte Patienten. Dass der Effekt einer solchen Kombination nicht nur unter Hinzunahme eines Androgensynthesehemmers, sondern auch eines ARPi, der den Androgenrezeptor direkt blockiert, effektiv ist, zeigen die Ergebnisse der TALAPRO2-Studie, die als Kombinationspartner Enzalutamid in einem ähnlichen Studiendesign einsetzte. Hier kam es zu einem signifikant verbesserten rPFS (27,9 Mo. vs. 16,4 Mo.; HR 0,46; 95%-KI 0,30–0,70; p < 0,001) [21]. Die Subgruppenauswertungen zeigen allerdings auch für die Kombinationstherapie ein noch deutlich besseres Ansprechen der Patienten, die einen Defekt in HRR-Genen aufweisen. Außerdem gibt es auch Studienergebnisse, die keinerlei Vorteil der Kombination bei nicht HRR-mutierten Patienten zeigen.
Fazit
Zusammenfassend ist festzuhalten, dass im letzten Jahr neue Therapieoptionen für mCRPC-Patienten zugelassen wurden, die das Therapiespektrum erweitern und die Prognose der Patienten verbessern werden (▶ Abb. 1). Nach diversen Neuzulassungen von ARPi und bereits Tripel-Therapien für hormonsensitive metastasierte Patienten werden in Zukunft im mCRPC-Stadium vor allem die Vortherapien über die weitere Therapiefolge entscheiden, da die Patienten nicht mehr mit einer Androgendeprivation alleine kastrationsresistent werden. Inwiefern sich LuPSMA frühzeitiger etabliert und PARP-Inhibitoren auch bei nicht HRR-mutierten Patienten eingesetzt werden, bleibt abzuwarten. Eine BRCA-Testung sollte im Sinne der neueren Erkenntnisse jedem kastrationsresistenten Patienten angeboten oder ermöglicht werden.

Korrespondenzadresse:
Univ.-Prof. Dr. med. Matthias Saar
Klinik für Urologie und Kinderuro logie,
Uniklinik RWTH Aachen
Center for Integrated Oncology Aachen
Bonn Cologne Düsseldorf (CIO ABCD),
Aachen, Germany
Pauwelsstr. 30
52074 Aachen
Tel.: 02418089374
msaar@ukaachen.de