Quelle und Bildquelle: © Aus UroForum, Heft 06/2023
Marc-Oliver Grimm, Katharina Leucht, Susan Foller, Andrea Rößler
Im Februar 2023 wurde die Dreifachkombination aus Darolutamid, Docetaxel und einer Androgendeprivation (ADT) in der EU für das metastasierte hormonsensitive Prostatakarzinom (mHSPC) zugelassen und ist neuer Standard of Care in diesem Setting. Eine randomisierte Phase-III-Studie ergab relevante Vorteile in Bezug auf höhegradige Nebenwirkungen mit einer Dosierung von 50 mg/m² Körperoberfläche Docetaxel im Vergleich zu 75 mg/m² Körperoberfläche. Vor diesem Hintergrund soll in der hier vorgestellten klinischen Studie ARASAFE die Hypothese überprüft werden, dass Patienten mit mHSPC auch bezüglich der Toxizität profitieren könnten, wenn eine Docetaxel-Dosis von 50 mg/m² Körperoberfläche verabreicht wird.
Jährlich wird bei etwa 70.000 Männern in Deutschland ein Prostatakarzinom diagnostiziert. Bei knapp jedem 5. Patienten ist der Tumor zum Zeitpunkt der Erstdiagnose bereits lokal fortgeschritten bzw. metastasiert [1] oder es kommt nach zunächst lokaler Therapie (z. B. Operation oder Bestrahlung) im Verlauf zur Ausbildung von Metastasen. Die Kombinationstherapie aus Darolutamimd, Docetaxel und ADT wurde im Februar 2023 in der Europäischen Union für das mHSPC zugelassen und ist ein neuer Standard of Care in diesem Setting. Die Zulassung basiert auf der randomisierten Phase-III-Studie ARASENS, welche zeigen konnte, dass die Dreifachkombination einen signifikanten Vorteil im Gesamtüberleben gegenüber einer Zweifach-Kombinationstherapie mit Docetaxel und ADT aufweist. Auch andere sekundäre Endpunkte wie die Zeit bis zum Auftreten eines kastrationsrefraktären Karzinoms (mCRPC), Schmerzprogression, symptomatische Knochenereignisse, Verschlechterung krankheitsbedingter körperlicher Symptome und Einleitung einer Folgetherapie zeigten Vorteile für die Dreifach-Kombination. In der ARASENS-Studie wurde Docetaxel für sechs Zyklen verbeicht. Die Dosierung betrug 75 mg/m² Körperoberfläche im Abstand von jeweils drei Wochen [2].
Im metastasierten kastrationsrefraktären Stadium empfiehlt die S3-Leitlinie eine Docetaxel-Chemotherapie sowohl in der Dosierung 75 mg/ m² Körperoberfläche alle 3 Wochen, so wie in der Zulassungsstudie verabreicht, als auch zweiwöchentlichen Abständen mit 50 mg/ m² Körperoberfläche (in 4-Wochen-Zyklen). Dies beruht auf einer randomisierten Phase-III-Studie, in der diese beiden Behandlungsschemata verglichen wurden. Es konnte gezeigt werden, dass die Zeit bis zum Versagen der Behandlung (primärer Endpunkt) mit zweiwöchentlichem Docetaxel 50 mg/m² signifikant länger als für die dreiwöchentliche Docetaxel-Gabe mit 75 mg/m² war (5,6 Monate [95%-Konfidenzintervall (KI) 5,0–6,2] vs 4,9 Monate [95%-KI 4,5–5,4]; Hazard Ratio (HR) 1,3 [95%-KI 1,1–1,6], p = 0,014). Besonders relevant waren die Daten zu den unerwünschten Ereignissen: Höhergradige Nebenwirkungen (Common Terminology Criteria for Adverse Events Grad 3–4) traten mit Docetaxel 50 mg/m² alle zwei Wochen deutlich seltener auf als für Docetaxel 75 mg/m² alle drei Wochen. Dies betraft u. a. Neutropenien (36 % vs. 53 %), Leukopenien (13 % vs. 29 %) und febrile Neutropenien (4 % vs. 14 %). Auch Neutropenie-assoziierte Infektionen wurden seltener bei Patienten gemeldet, die eine zweiwöchentliche Therapie erhielten (6 % vs. 24 %) [3].
Vor diesem Hintergrund gehen wir davon aus, dass Patienten mit mHSPC, die mit der Dreifachkombination aus Darolutamid, Docetaxel und ADT behandelt werden, ebenfalls in Bezug auf die Toxizität profitieren könnten, wenn Docetaxel in einer Dosierung von 50 mg/m² alle zwei Wochen verabreicht wird. Diese Hypothese möchten wir in unserer hier vorgestellten klinischen Studie ARASAFE überprüfen.
ARASAFE
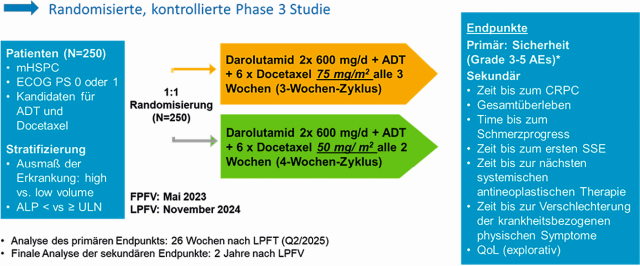
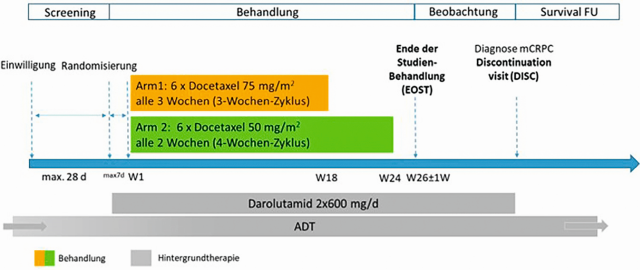
Bei ARASAFE handelt es sich um eine randomierte, offene, multizentrische Phase-III-Studie. Geplant ist die Evaluation von 250 Patienten mit mHSPC, die während sechs Therapiezyklen entweder mit Docetaxel 75 mg/m2 alle drei Wochen in einem 3-Wochen-Zyklus oder mit Docetaxel 50 mg/m2 alle zwei Wochen in einem 4-Wochen-Zyklus behandelt werden. Die Chemotherapie wird jeweils kombiniert mit Darolutamid und ADT verabreicht.
Ein-und Ausschlusskriterien
Bei infrage kommenden Patienten muss ein histologisch oder zytologisch bestätigtes Adenokarzinom der Prostata im metastasierten Stadium vorliegen. Eine isolierte Lymphknoten-Metastasierung, egal ob unterhalb der Aortenbifurkation (N1) oder oberhalb (M1a) – eine Gruppe, die in der ARASENS-Studie nur einen Anteil von 3 % ausmachte – kommen nicht für die Studie in Betracht. Die Patienten müssen nach Einschätzung des Prüfarztes für eine ADT-, Docetaxel- und Darolutamid-Therapie geeignet sein sowie einen guten Performance Status aufweisen (Eastern Cooperative Oncology Group von 0 oder 1). Eine bereits begonnene Behandlung mit ADT (LHRH-Agonist/Antagonist oder Orchiektomie) nicht länger als 12 Wochen vor der Randomisierung ist ein weiteres Einschlusskriterium für diese Studie. Für Patienten, die LHRH-Agonisten erhalten, wird eine Behandlung in Kombination mit einem Antiandrogen der ersten Generation für mindestens 4 Wochen vor der Randomisierung empfohlen. Anti-Androgene der ersten Generation müssen vor der Randomisierung abgesetzt werden. Die Behandlung mit Darolutamid beginnt nach der Randomisierung und vor der ersten Gabe von Docetaxel.
Ausschlusskriterien beinhalten die vorherige Behandlung mit LHRH-Agonist/-Antagonisten, deren Behandlung vor mehr als 12 Wochen vor der Randomisierung begonnen wurde, mit Androgenrezeptor-Inhibitoren der zweiten Generation wie Enzalutamid, Apalutamid, Darolutamid, mit Cytochrom P17 Enzyminhibitoren wie Abirateronacetat oder oralem Ketoconazol als antineoplastische Behandlung von Prostatakrebs. Auch andere Vortherapien wie Chemotherapie, Immuntherapie, Radium oder andere therapeutische Radiopharmaka bei Prostatakrebs (z. B. Lutetium177-PSMA) vor der Randomisierung sind ausgeschlossen.
Studienendpunkte
Primärer Endpunkt ist der Vergleich von unerwünschten Ereignissen der Grade 3–5 zwischen dem 2- und 3-wöchentlichen Docetaxel-Dosierungsschema. Die Auswertung des primären Endpunktes erfolgt 26 Wochen nach der ersten verabreichten Dosis Docetaxel des letzten eingeschlossenen Patienten, sodass diese Analyse voraussichtlich bereits 2025 ausgewertet werden kann. Sekundäre Endpunkte, die gemeinsam mit dem primären Endpunkt berichtet werden, sollen u. a. das PSA-Ansprechen (PSA ≤ 0,2; > 0,2–4,0 und > 4,0 ng/ml) als Surrogat-Parameter für den weiteren onkologischen Verlauf beinhalten. Nach der Analyse des primären Endpunktes folgen noch 2 Jahre Beobachtung des weiteren onkologischen Verlaufs, um die Effektivität der Behandlungsregime darzustellen. Diese sekundären Endpunkte umfassen Zeit bis zum kastrationsresistenten Prostatakrebs, Gesamtüberleben, Zeit bis zum Beginn einer weiteren antineoplastischen Therapie, und Zeit bis zum ersten symptomatischen skelettalen Ereignis (SSE). Auch „Patient Reported Outcomes“ wie Zeit bis zum Fortschreiten von Schmerzen, Zeit bis zur Verschlechterung physischer Krankheitssymptome (basierend auf einer Erfassung mit dem Functional Assessment of Cancer Therapy/National Comprehensive Cancer Network Prostate Cancer Symptom Index 17-Punkte-Fragebogen [NCCN-FACT FPSI-17]) werden erfasst, ebenso wie eine Langzeit-Sicherheit und Verträglichkeit. Ein explorativer Endpunkt ist die Lebensqualität. Das Studiendesign ist in ▶ Abbildung 1, S. 19, sowie im zeitlichen Verlauf in ▶ Abbildung 2 dargestellt.
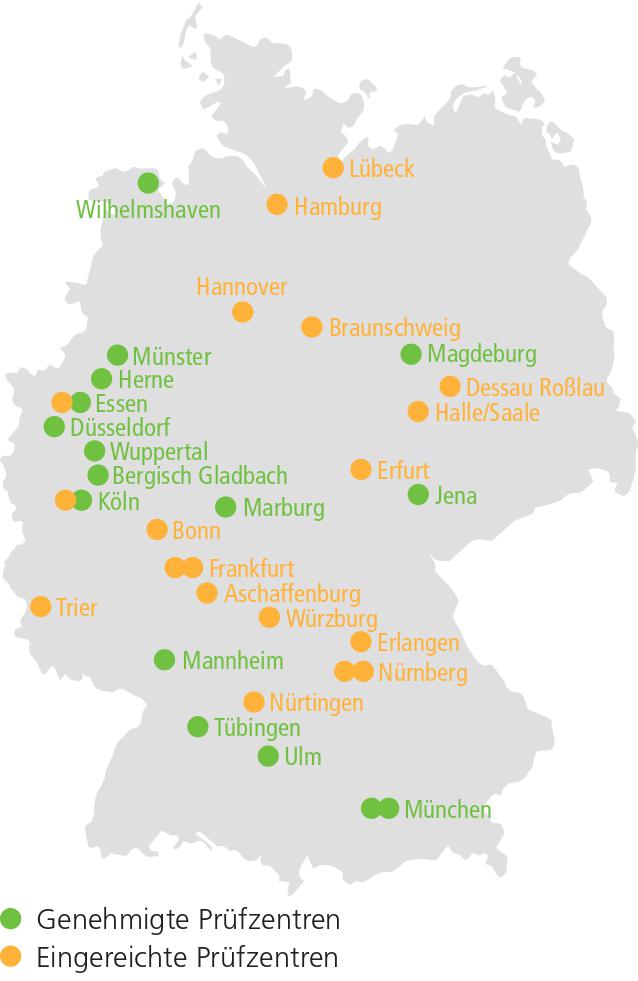
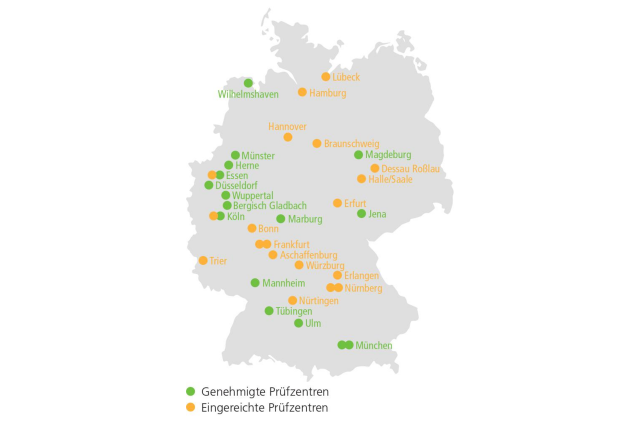
Das Studienprotokoll wurde nach EU Verordnung 536/2014 eingereicht (02.02.2023), wenige Tage nachdem die positive CHMP-Opinion für die Therapie von Darolutamid, Docetaxel und ADT beim mHSPC vorlag (28.01.2023). Nach Beantwortung von Rückfragen wurde am 10.05.2023 die Genehmigung der zuständigen Behörden (BfArM, Ethikkommission) erteilt. Somit kann die Studie zum jetzigen Zeitpunkt in 16 der geplanten 40 deutschen Zentren begonnen werden. Als erstes Zentrum wurde bereits die Urologische Klinik des Universitätsklinikums Jena initiiert und auch die ersten Patienten konnten schon in die Studie eingeschlossen werden. Die übrigen in der ersten Einreichungswelle inkludierten Prüfzentren werden in den nächsten Wochen ebenfalls initiiert werden. Weitere 19 Zentren wurden bereits in einer zweiten Welle eingereicht. Die bereits genehmigten sowie die eingereichten Zentren sind in ▶ Abbildung 3 dargestellt.
Fazit
Bei ARASAFE handelt es sich um eine Untersucher-initiierte deutsche Multicenterstudie mit breiter Unterstützung durch 40 Prüfzentren bzw. Studienteams. Bitte unterstützen Sie diese Studie und damit den Studienstandort Deutschland!

Korrespondenzadresse:
Prof. Dr. med. Marc-Oliver Grimm
Direktor der Urologischen Klinik und Poliklinik
Universitätsklinikum Jena
Am Klinikum 1
07747 Jena
Tel.: +49–3641–9329901
marc-oliver.grimm@med.uni-jena.de